Howard
New member
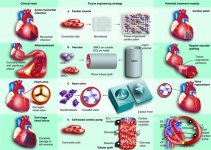
بیماری های دریچه ی قلبی یکی از مهمترین دلایل مرگ و میر در سطح جهان محسوب می شود. جراحی های جایگزین و تعویض کلاسیک دریچه شامل ایمپلنت دریچه های مکانیکی و یا انواع بیولوژیکی آن به صورت هومو یا زنوگرفت می شود. مهندسی دریچه های قلبی ایده های تجربی تازه ای را برای بهبودبخشی به مدهای درمانی پیرامون این نوع جراحی ها عرضه کرده است. خط مشی های گوناگونی در زمینه انتخاب داربست و نیز دستیابی به منابع سلولی و یافتن راه حل هایی برای تعامل این دو پیشنهاد شده است. این داربست ها از پلیمرهای مصنوعی زیست تخریب پذیر و یا داربست هایی که از زدایش سلولی قلب طبیعی ایجاد شده و می توانند هوموگرفت یا زنوگرفت باشد ، نشأت می گیرد. به علاوه منابع سلولی می تواند از سلول های مشتق شده از عروق ، مغز استخوان و یا سلول های نیایی از خون محیطی باشد. آنچه در مورد مهندسی دریچه های قلبی حائز اهمیت است ، ترکیب این دو مقوله به جهت رسیدن به یک پروتز ایمن و کامل است. به علاوه چنین سلول هایی به راحتی و با روش های روتین کلینیکی قابل دستیابی است. تاکنون از پتانسیل این سلول ها برای تمایز به رده ی Non-Hematopoietic بهره گرفته شده است.
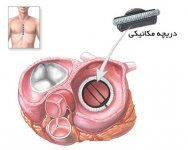
دریچه مکانیکی قلب
همانطور که اشاره شد ، بیماری های مربوط به دریچه ی قلب و نقصان عملکرد آن از دلایل بسیار عمده مرگ و میر در سراسر جهان محسوب می شود. در ایالات متحده آمریکا تقریباً بیست هزار نفر به صورت سالیانه و به طور مستقیم به علت نقایص دریچه های قلبی از بین می روند. همچنین 60 هزار جراحی تعویض دریچه صورت می پذیرد. جراحی تعویض دریچه روشی مؤثر بوده که طی آن دریچه های مکانیکی و یا بیولوژیکی همانند دریچه های ثابت گلوتار آلدهید به صورت زنوگرفت از حیوانات و یا دریچه های هوموگرفت انسانی و منجمد شده که از اهداکنندگان داوطلب جایگزین دریچه های بیمار می شوند. مشکل اصلی دریچه های مکانیکی این است که چنین پروتز هایی مواد غیرخودی و بیگانه را به بدن عرضه می نماید. از طرف دیگر ، خطر ابتلا به عفونت و نیز عوارض ترومبوآمبولیک افزایش پیدا می کند. برای جلوگیری از چنین عارضه ای از درمان هایی که به مدت طولانی نقش ضد انعقادی را برای خون برعهده می گیرند ، استفاده می شود که به نوبه ی خود خطر خونریزی های شدید را به دنبال خواهد داشت. جدای از این ، مشکلات مضاعفی نظیر مسمومیت جنینی در زنان جوان باردار ، به علت مصرف وارفارین که از لخته شدن خون بر روی دریچه ی ایمپلنت شده ممانعت می کند ، بروز می نماید. استفاده از دریچه های بیولوژیکی این موضوع را الزام می دارد که هر 10 الی 15 سال این پروتز ها تعویض شوند که البته در افراد جوان تر به علت سطوح بالاتر عملکردهای سیستم ایمنی این مدت زمان کمتر است. اساساً تمامی پروتزهای کلینیکی موجود ساختارهای غیرزیستایی را نشان داده و فاقد قابلیت رشد هستند. چنین فقدانی در کودکانی که دچار عارضه ی دریچه ای هستند به طور محسوسی خود را نشان می دهد. تقریباً یک درصد از تمامی نوزادان دارای نقایص مادرزادی دریچه ی قلبی بوده و نیز تعدادی از آنها نیازمند به اعمال جراحی باز قلب برای تعویض دریچه هستند. چون دریچه های موجود فاقد توانایی رشد است ، لذا تکرار چنین تعویضی طی سالیان متمادی سبب افزایش میزان مرگ و میر در بین کودکان تحت عمل جراحی می شود.
ایده ی مهندسی پزشکی در راستای مهندسی دریچه های قلب
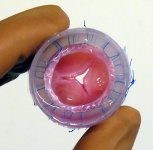
به منظور غلبه بر محدودیت های وارد بر روش های تعویض دریچه ، ایده کاربرد مهندسی پزشکی در راستای استفاده از داربست و تعامل آن با سلول ها برای تولید دریچه مطرح شد. این رویکرد شامل داربست های مصنوعی و زیست تخریب پذیری بود که در آن ها سلول های مشتق شده از خود فرد کشت می شد. همچنین استفاده از داربست های زدایش سلولی شده که به صورت آلوگرفت و زنوگرفت مورد استفاده قرار می گرفتند ، مورد بررسی واقع شدند. هدف نهایی مهندسی بافت تولید سازه های بافتی توسط سه جز سلول ، داربست و فاکتورهای رشد مربوطه است. لذا برای تولید یک دریچه با عملکرد مناسب ، پارامترهایی مانند خصوصیات و ویژگی های مکانیکی ، مانایی دریچه ، عملکرد همودینامیکی مناسب ، عدم بروز پاسخ های ایمونولوژی و التهابی ، مورد بررسی واقع می شود.
موفقیت دریچه های قلبی مهندسی شده یا Tissue Engineered Heart Valves به سه موضوع مهم وابسته است:
1- داربست یا ماتریکسی که بتواند فضایی سه بعدی با ساختمان اولیه ی هدایت کننده جهت ضمیمه ی سلول و به دنبال آن توسعه ی سازه بافتی ، فراهم آورد.
2- منابع سلولی مناسب
3- شرایط آزمایشگاهی مناسب برای کشت بافت زنده قبل از کاشت در بدن
داربست های حاصل از پلیمرهای مصنوعی
پلیمرهای زیست تخریب پذیر مانند پلی گلاکتین (Polyglactin ، (PGA ، PLA ، PLGA ، کوپلیمر پلی گالاکوئیک اسید و پلی لاکتیک اسید برای کاربردهای مهندسی بافت قلبی عروقی مفید است. چنین موادی برای کاربردهای جراحی مورد پذیرش بوده ، به علاوه کاملا زیست سازگار و زیست تخریب پذیر است. اخیراً داربست های پلیمری شامل پلی گالاکوئیک اسید به صورت غیر بافته که به وسیله ی Poly4Hydroxy Butirate پوشش داده شده است ، معرفی شدند. ترکیب چنین پلیمرهایی سبب عرضه ی خواص ترموپلاستیکی می شود که امکان الگو زدن داربست ها را برای تولید اشکال سه بعدی پیچیده میسر می سازد. چنین رویکردی در تولید دریچه های سه لتی قلبی مفید است. مهمترین مزیت مواد مصنوعی خصوصیت زیست تخریب پذیری و خصلت بیومکانیکی مناسب آنهاست که می تواند به صورت شیمیایی و بر اساس نیازهای مطرح شده برای کاربردهای خاص طراحی شود. همچنین پروتئین های خاصی مانند فاکتورهای رشد به منظور ارتقای تمایز سلول ها به بافت موردنظر مورد نیاز است.

دریچه مکانیکی قلب
همانطور که اشاره شد ، بیماری های مربوط به دریچه ی قلب و نقصان عملکرد آن از دلایل بسیار عمده مرگ و میر در سراسر جهان محسوب می شود. در ایالات متحده آمریکا تقریباً بیست هزار نفر به صورت سالیانه و به طور مستقیم به علت نقایص دریچه های قلبی از بین می روند. همچنین 60 هزار جراحی تعویض دریچه صورت می پذیرد. جراحی تعویض دریچه روشی مؤثر بوده که طی آن دریچه های مکانیکی و یا بیولوژیکی همانند دریچه های ثابت گلوتار آلدهید به صورت زنوگرفت از حیوانات و یا دریچه های هوموگرفت انسانی و منجمد شده که از اهداکنندگان داوطلب جایگزین دریچه های بیمار می شوند. مشکل اصلی دریچه های مکانیکی این است که چنین پروتز هایی مواد غیرخودی و بیگانه را به بدن عرضه می نماید. از طرف دیگر ، خطر ابتلا به عفونت و نیز عوارض ترومبوآمبولیک افزایش پیدا می کند. برای جلوگیری از چنین عارضه ای از درمان هایی که به مدت طولانی نقش ضد انعقادی را برای خون برعهده می گیرند ، استفاده می شود که به نوبه ی خود خطر خونریزی های شدید را به دنبال خواهد داشت. جدای از این ، مشکلات مضاعفی نظیر مسمومیت جنینی در زنان جوان باردار ، به علت مصرف وارفارین که از لخته شدن خون بر روی دریچه ی ایمپلنت شده ممانعت می کند ، بروز می نماید. استفاده از دریچه های بیولوژیکی این موضوع را الزام می دارد که هر 10 الی 15 سال این پروتز ها تعویض شوند که البته در افراد جوان تر به علت سطوح بالاتر عملکردهای سیستم ایمنی این مدت زمان کمتر است. اساساً تمامی پروتزهای کلینیکی موجود ساختارهای غیرزیستایی را نشان داده و فاقد قابلیت رشد هستند. چنین فقدانی در کودکانی که دچار عارضه ی دریچه ای هستند به طور محسوسی خود را نشان می دهد. تقریباً یک درصد از تمامی نوزادان دارای نقایص مادرزادی دریچه ی قلبی بوده و نیز تعدادی از آنها نیازمند به اعمال جراحی باز قلب برای تعویض دریچه هستند. چون دریچه های موجود فاقد توانایی رشد است ، لذا تکرار چنین تعویضی طی سالیان متمادی سبب افزایش میزان مرگ و میر در بین کودکان تحت عمل جراحی می شود.
ایده ی مهندسی پزشکی در راستای مهندسی دریچه های قلب
به منظور غلبه بر محدودیت های وارد بر روش های تعویض دریچه ، ایده کاربرد مهندسی پزشکی در راستای استفاده از داربست و تعامل آن با سلول ها برای تولید دریچه مطرح شد. این رویکرد شامل داربست های مصنوعی و زیست تخریب پذیری بود که در آن ها سلول های مشتق شده از خود فرد کشت می شد. همچنین استفاده از داربست های زدایش سلولی شده که به صورت آلوگرفت و زنوگرفت مورد استفاده قرار می گرفتند ، مورد بررسی واقع شدند. هدف نهایی مهندسی بافت تولید سازه های بافتی توسط سه جز سلول ، داربست و فاکتورهای رشد مربوطه است. لذا برای تولید یک دریچه با عملکرد مناسب ، پارامترهایی مانند خصوصیات و ویژگی های مکانیکی ، مانایی دریچه ، عملکرد همودینامیکی مناسب ، عدم بروز پاسخ های ایمونولوژی و التهابی ، مورد بررسی واقع می شود.
موفقیت دریچه های قلبی مهندسی شده یا Tissue Engineered Heart Valves به سه موضوع مهم وابسته است:
1- داربست یا ماتریکسی که بتواند فضایی سه بعدی با ساختمان اولیه ی هدایت کننده جهت ضمیمه ی سلول و به دنبال آن توسعه ی سازه بافتی ، فراهم آورد.
2- منابع سلولی مناسب
3- شرایط آزمایشگاهی مناسب برای کشت بافت زنده قبل از کاشت در بدن
داربست های حاصل از پلیمرهای مصنوعی
پلیمرهای زیست تخریب پذیر مانند پلی گلاکتین (Polyglactin ، (PGA ، PLA ، PLGA ، کوپلیمر پلی گالاکوئیک اسید و پلی لاکتیک اسید برای کاربردهای مهندسی بافت قلبی عروقی مفید است. چنین موادی برای کاربردهای جراحی مورد پذیرش بوده ، به علاوه کاملا زیست سازگار و زیست تخریب پذیر است. اخیراً داربست های پلیمری شامل پلی گالاکوئیک اسید به صورت غیر بافته که به وسیله ی Poly4Hydroxy Butirate پوشش داده شده است ، معرفی شدند. ترکیب چنین پلیمرهایی سبب عرضه ی خواص ترموپلاستیکی می شود که امکان الگو زدن داربست ها را برای تولید اشکال سه بعدی پیچیده میسر می سازد. چنین رویکردی در تولید دریچه های سه لتی قلبی مفید است. مهمترین مزیت مواد مصنوعی خصوصیت زیست تخریب پذیری و خصلت بیومکانیکی مناسب آنهاست که می تواند به صورت شیمیایی و بر اساس نیازهای مطرح شده برای کاربردهای خاص طراحی شود. همچنین پروتئین های خاصی مانند فاکتورهای رشد به منظور ارتقای تمایز سلول ها به بافت موردنظر مورد نیاز است.
آخرین ویرایش: